金刚石和石墨的区别:原子排列方式不同、色态不同、硬度不同、导电性不同。
1、原子排列方式不同
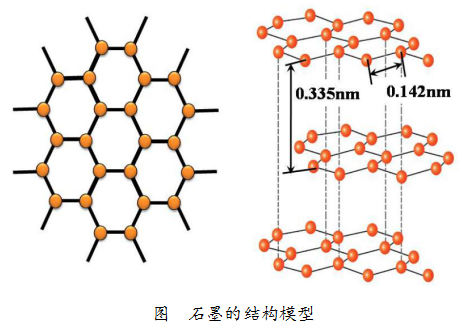
石墨是层状的结构,就一个片层而言,每1个碳原子会与其周围的3个碳原子通过强烈的相互作用紧密结合,“紧密结合”的两个碳原子之间的距离约为0.142nm。
在石墨中层与层之间相距为0.335nm,由于距离比较大,碳原子的相互作用较弱,因此很容易沿着与层面平行的方向滑动、姿带裂解,所以石墨很软、有滑腻感。
金刚石的结构模型是每个碳原迹手芦子都与周围的4个碳原子通过强烈的相互作用紧密结合。“紧密结合”的两个碳原子之间的距离约为0.155nm,从而形成致密的三维结构,正是这种致密的结构,使得金刚石成为天然存在的最坚硬的物质。
2、色态不同
石墨:深灰色、有金属光泽、细鳞片状固体。金刚石:无色透明、正八面体形状的固体。
3、硬度不同
石墨:最软的矿物质之一。金刚石:天然最硬的物质。
4、导电性不同
石墨:导电良好。碳原子最外层有4个电子,在石墨的一个片层中,每个碳原子会与其周围的3个碳原子通过“共用电子对”形成强烈的相互作用(化学键),每个碳原子只有3个最外层电子参与这种“力”的形成,这样就会剩下1个自由电子。
因为有大量自由电子存在,所以石墨能导电。
金刚石:不导电。金刚石中每个碳原子与其周围的4个碳原子通过“共用电子对”形成强烈的相互作用,碳原子最外层的4个电子几薯洞乎都参与了这种“力”的形成,基本没有自由电子,所以基本不导电。
标签:金刚石